siklus ideal
- Siklus yang digunakan utk memudahkan analisa motor bakar.
- Siklus yg jauh menyimpang dari kondisi aktual
- Pada umumnya digunakan SIKLUS UDARA
- Siklus Udara Volume – Konstan (SIKLUS OTTO)
- Siklus Udara Tekanan – Konstan (SIKLUS DIESEL)
- Siklus Udara Tekanan – Terbatas (SIKLUS GABUNGAN)
download materi
–SIKLUS DIESEL
–Motor bakar
–Siklus Otto dan Diesel
siklus udara volume konstan

PROSES SIKLUS
0-1 : Pemasukan BB pd P konstan
1-2 : Kompresi Isentropis
2-3 : Pemasukan kalor pd V konstan
3-4 : Ekspansi Isentropis
4-1 : Pembuangan kalor pd V konstan
1-0 : Pembuangan gas buang pd P konstan
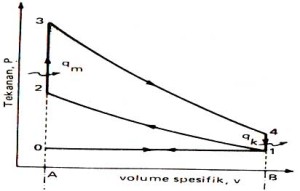
siklus tekanan konstan


PROSES SIKLUS
0-1 : Pemasukan BB pd P konstan
1-2 : Kompresi Isentropis
2-3 : Pemasukan kalor pd P konstan
3-4 : Ekspansi Isentropis
4-1 : Pembuangan kalor pd V konstan
1-0 : Pembuangan gas buang pd P konstan
siklus gabungan
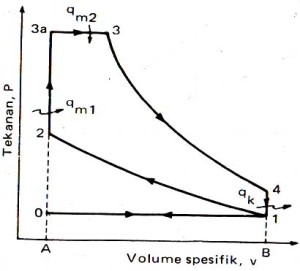
proses siklus:
0-1 : Pemasukan BB pd P konstan
1-2 : Kompresi Isentropis
2-3a : Pemasukan kalor pd V konstan
3a-3 : Pemasukan Kalor pd P konstan
3-4 : Ekspansi Isentropis
4-1 : Pembuangan kalor pd V konstan
1-0 : Pembuangan gas buang pd P konstan
Secara
thermodinamika, siklus ini memiliki 4 buah proses thermodinamika yang
terdiri dari 2 buah proses isokhorik (volume tetap) dan 2 buah proses
adiabatis (kalor tetap). Untuk lebih jelasnya dapat dilihat diagram
tekanan (p) vs temperatur (V) berikut:

Proses yang terjadi adalah :
1-2 : Kompresi adiabatis
2-3 : Pembakaran isokhorik
3-4 : Ekspansi / langkah kerja adiabatis
4-1 : Langkah buang isokhorik
- Siklus Termodinamika
Idealisasi proses tersebut sebagai berikut:
- Fluida kerja dari awal proses hingga akhir proses.
- Panas jenis dianggap konstan meskipun terjadi perubahan temperatur pada udara.
- Proses kompresi dan ekspansi berlangsung secara adiabatik, tidak terjadi perpindahan panas antara gas dan dinding silinder.
- Sifat-sifat kimia fluida kerja tidak berubah selama siklus berlangsung.
- Motor 2 (dua) langkah mempunyai siklus termodinamika yang sama dengan motor 4 (empat) langkah.

Gambar 2. 1. Diagram P-V dan T-S siklus otto
(Cengel & Boles, 1994 : 451)
- Siklus Otto (Siklus udara volume konstan)
 Gambar 2. 2. Diagram P-V dan T-S siklus otto
Gambar 2. 2. Diagram P-V dan T-S siklus otto(Cengel & Boles, 1994 : 458)
Proses siklus otto sebagai berikut :
Proses 1-2 : proses kompresi isentropic (adiabatic reversible) dimana piston bergerak menuju (TMA=titik mati atas) mengkompresikan udara sampai volume clearance sehingga tekanan dan temperatur udara naik.
Proses 2-3 : pemasukan kalor konstan, piston sesaat pada (TMA=titik mati atas) bersamaan kalor suplai dari sekelilingnya serta tekanan dan temperatur meningkat hingga nilai maksimum dalam siklus.
Proses 3-4 : proses isentropik udara panas dengan tekanan tinggi mendorong piston turun menuju (TMB=titik mati bawah), energi dilepaskan disekeliling berupa internal energi.
Proses 4-1 : proses pelepasan kalor pada volume konstan piston sesaat pada (TMB=titik mati bawah) dengan mentransfer kalor ke sekeliling dan kembali mlangkah pada titik awal.
Beberapa rumus yang digunakan untuk menganalisa sebuah siklus Otto adalah sebagai berikut :
1. Proses Kompresi Adiabatis
T2/T1 = r^(k-1); p2/p1 = r^k
2. Proses Pembakaran Isokhorik
T3 = T2 + (f x Q / Cv) ; p3 = p2 ( T3 / T2)
3. Proses Ekspansi / Langkah Kerja
T4/T3 = r^(1-k) ; p4/p3 = r^(-k)
4. Kerja Siklus
W = Cv [(T3 – T2) – (T4 – T1)]
5. Tekanan Efektif Rata-rata (Mean Effective Pressure)
pme = W / (V1 – V2)
6. Daya Indikasi Motor
Pe = pme . n . i . (V1-V2) . z
Dimana parameter – parameternya adalah :
p = Tekanan gas (Kg/m^3)
T = Temperatur gas (K; Kelvin)
V = Volume gas (m^3)
r = Rasio kompresi (V1 – V2)
Cv = Panas jenis gas pada volume tetap ( kj/kg K)
k = Rasio panas jenis gas (Cp/Cv)
f = Rasio bahan bakar / udara
Q = Nilai panas bahan bakar (kj/kg)
W = Kerja (Joule)
n = Putaran mesin per detik (rps)
i = Index pengali; i=1 untuk 2 tak dan i=0.5 untuk 4 tak
z = Jumlah silinder
P = Daya ( Watt )
Siklus Otto

campuran meningkat. Pada saat yang sama, busi memercikkan bunga api sehingga campuran udara dan uap bensin terbakar. Ketika terbakar, suhu dan tekanan gas semakin bertambah. Gas bersuhu tinggi dan bertekanan tinggi tersebut memuai terhadap piston dan mendorong piston ke bawah (langkai pemuaian). Selanjutnya gas yang terbakar dibuang melalui katup pembuangan dan dialirkan menuju pipa pembuangan (langkah pembuangan).Katup masukan terbuka lagi dan keempat langkah diulangi.
Perlu diketahui bahwa tujuan dari adanya langkah kompresi alias penekanan adiabatik adalah menaikkan suhu dan tekanan campuran udara dan uap bensin. Proses pembakaran pada tekanan yang tinggi akan menghasilkan suhu dan tekanan (P = F/A) yang sangat besar. Akibatnya gaya dorong (F = PA) yang dihasilkan selama proses pemuaian menjadi sangat besar. Mesin motor atau mobil menjadi lebih bertenaga… Walaupun tidak ditekan, campuran udara dan uap bensin bisa terbakar ketika si busi memercikkan bunga api. Tapi suhu dan tekanan gas yang terbakar tidak terlalu tinggi sehingga gaya dorong yang dihasilkan juga kecil. Akibatnya mesin menjadi kurang bertenaga.

Proses perubahan bentuk energi dan perpindahan energi pada mesin pembakaran dalam empat langkah di atas bisa dijelaskan seperti ini : Ketika terjadi proses pembakaran, energi potensial kimia dalam bensin + energi dalam udara berubah menjadi kalor alias panas. Sebagian kalor berubah menjadi energi mekanik batang piston dan poros engkol, sebagian kalor dibuang melalui pipa pembuangan (knalpot). Sebagian besar energi mekanik batang piston dan poros engkol berubah menjadi energi mekanik kendaraan (kendaraan bergerak), sebagian kecil berubah menjadi kalor alias panas… Panas timbul akibat adanya gesekan.
Proses pemuaian dan penekanan secara adiabatik pada siklus otto bisa digambarkan melalui diagram di bawah… (Diagram ini menunjukkan model ideal dari proses termodinamika yang terjadi pada mesin pembakaran dalam yang menggunakan bensin).
Campuran udara dan uap bensin masuk ke dalam silinder (a). Selanjutnya campuran udara dan uap bensin ditekan secara adiabatik (a-b). Perhatikan bahwa volume silinder berkurang… Campuran udara dan uap bensin dipanaskan pada volume konstan – campuran dibakar (b-c). Gas yang terbakar mengalami pemuaian adiabatik (c-d). Pendinginan pada volume konstan – gas yang terbakar dibuang ke pipa pembuangan dan campuran udara + uap bensin yang baru, masuk ke silinder (d-a).
Siklus Diesel

Prinsip kerja mesin diesel mirip seperti mesin bensin. Perbedaannya terletak pada langkah awal kompresi alias penekanan adiabatik (penekanan adiabatik = penekanan yang dilakukan dengan sangat cepat sehingga kalor alias panas tidak sempat mengalir menuju atau keluar dari sistem. Sistem untuk kasus ini adalah silinder). Kalau dalam mesin bensin, yang ditekan adalah campuran udara dan uap bensin, maka dalam mesin diesel yang ditekan hanya udara saja… Penekanan secara adiabatik menyebabkan suhu dan tekanan udara meningkat. Selanjutnya injector alias penyuntik menyemprotkan solar. Karena suhu dan tekanan udara sudah sangat tinggi maka ketika solar disemprotkan ke dalam silinder, si solar langsung terbakar… Tidak perlu pake busi lagi. Perhatikan besarnya tekanan yang ditunjukkan pada diagram di bawah… bandingkan dengan besarnya tekanan yang ditunjukkan pada diagram siklus otto
Diagram ini menunjukkan siklus diesel ideal alias sempurna… Mula-mula udara ditekan secara adiabatik (a-b), lalu dipanaskan pada tekanan konstan – penyuntik alias injector menyemprotkan solar dan terjadilah pembakaran (b-c), gas yang terbakar mengalami pemuaian adiabatik (c-d), pendinginan pada volume konstan – gas yang terbakar dibuang ke pipa pembuangan dan udara yang baru, masuk ke silinder (d-a). Selengkapnya bisa dipelajari di dunia perteknik-otomotifan.Gurumuda hanya memberimu pengetahuan dasar saja.
Dari penjelasan yang bertele-tele di atas, kita bisa menyimpulkan bahwa setiap mesin kalor pada dasarnya memiliki zat kerja tertentu. Zat kerja untuk mesin uap adalah air, zat kerja untuk mesin bensin adalah udara dan uap bensin, zat kerja untuk mesin diesel adalah udara dan solar. Zat kerja biasanya menyerap kalor pada suhu yang tinggi (QH), melakukan usaha alias kerja (W), lalu membuang kalor sisa pada suhu yang lebih rendah (QL). Karena si energi kekal, maka QH = W + QL.








0 komentar:
Posting Komentar